أيونات
ما هي الأيونات:
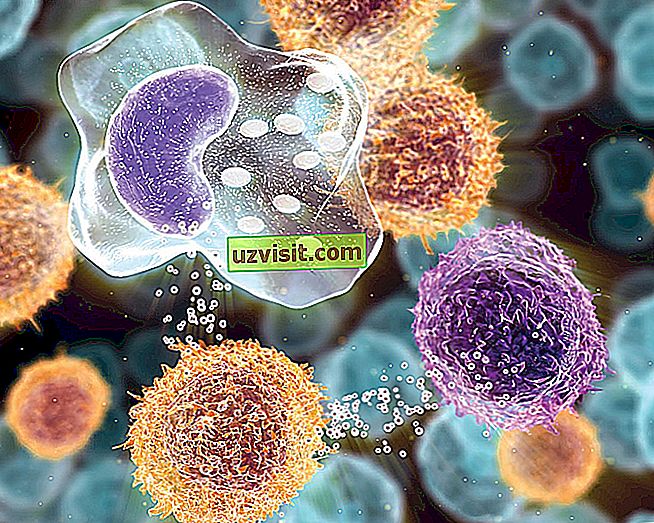
الأيونات هي مكون كيميائي ينتج عن عملية فقد أو كسب الإلكترون من خلال التفاعلات المشحونة بالكهرباء.
يظهر هذا المكون الكيميائي في التفاعلات الناجمة عن الحاجة إلى أن تحتوي الذرة على نفس الكمية من البروتونات والإلكترونات.
الكاتيون وأنيون
يتم تصنيف الأيونات حسب الشحنة الكهربائية التي تتلقاها. إذا كانت هذه الشحنة سالبة ، يتم تصنيفها على أنها أنيون ، تنجذب بواسطة الأنود ، القطب الذي يتم من خلاله شحن الشحنة الكهربائية الإيجابية إلى داخل جهاز كهربائي مستقطب.
إذا كانت الشحنة موجبة ، يتم تصنيف الأيونات على أنها كاتيون ويتم جذبها بواسطة الكاثود ، وهو القطب الذي يترك التيار الكهربائي جهازًا كهربائيًا مستقطبًا.
يمكن أيضًا تسمية الأيونات وفقًا لعدد الأيونات المستلمة. إنها حالة المغنيسيوم (Mg2 +) ، والتي تسمى الكاتيون ثنائي التكافؤ أو أيون ثنائي التكافؤ الإيجابي ببساطة ، أو الفلور (F-) ، والذي يطلق عليه أنيون أحادي التكافؤ أو أيون سلبي أحادي التكافؤ.
الرابطة الأيونية
يمكن للأيونات أيضًا إجراء اتصالات بين الأيونات الموجبة والسالبة. هذا هو ما يسمى الرابطة الأيونية ، حيث لدينا على سبيل المثال ما يحدث في تشكيل كلوريد الصوديوم ، ملح المطبخ. في هذه الحالة ، يرتبط الصوديوم (Na +) بالكلور (Cl -) ، وفقًا للتفاعل التالي:
Na + + Cl- → NaCl
إمكانات التأين
يحتاج الأيونات أيضًا إلى الحد الأدنى من الطاقة لسحب الإلكترون من الغلاف الكهربي ، خاصةً عندما يكون في الحالة الغازية ولم يخضع لأي منبهات. هذا هو ما يسمى إمكانات التأين .
وبهذه الطريقة ، كلما زادت الطاقة التي تتلقاها الذرة ، انخفض ميلها لتصبح كاتيون (أيون إيجابي).
الهالوجينات هي العناصر التي تقدم أكبر إمكانات التأين. على عكس المعادن بشكل عام.
انظر أيضا معنى التأين والتأين.